Fernanda Marques
 “O estado atual do desenvolvimento da vacina de Oxford” foi o tema de uma audiência pública realizada nesta quarta-feira (30/9) pela Comissão Externa da Câmara dos Deputados destinada a acompanhar o Enfrentamento à Pandemia da Covid-19 no Brasil. Participaram da audiência a presidente da Fiocruz, Nísia Trindade Lima; o vice-presidente de Gestão e Desenvolvimento Institucional, Mario Moreira; e o vice-presidente de Produção e Inovação em Saúde, Marco Krieger. Os representantes da Fiocruz reafirmaram o cronograma do desenvolvimento da vacina contra Covid-19, com o início da produção em dezembro de 2020, se confirmados os bons resultados dos estudos clínicos de fase 3 que estão sendo conduzidos no Brasil e em outros países, como Reino Unido, Estados Unidos, África do Sul e Índia. Asseguraram também o rigor científico e ético com que todo o trabalho tem sido realizado, tanto a pesquisa clínica como os preparativos para o início da fabricação no Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos/Fiocruz).
“O estado atual do desenvolvimento da vacina de Oxford” foi o tema de uma audiência pública realizada nesta quarta-feira (30/9) pela Comissão Externa da Câmara dos Deputados destinada a acompanhar o Enfrentamento à Pandemia da Covid-19 no Brasil. Participaram da audiência a presidente da Fiocruz, Nísia Trindade Lima; o vice-presidente de Gestão e Desenvolvimento Institucional, Mario Moreira; e o vice-presidente de Produção e Inovação em Saúde, Marco Krieger. Os representantes da Fiocruz reafirmaram o cronograma do desenvolvimento da vacina contra Covid-19, com o início da produção em dezembro de 2020, se confirmados os bons resultados dos estudos clínicos de fase 3 que estão sendo conduzidos no Brasil e em outros países, como Reino Unido, Estados Unidos, África do Sul e Índia. Asseguraram também o rigor científico e ético com que todo o trabalho tem sido realizado, tanto a pesquisa clínica como os preparativos para o início da fabricação no Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos/Fiocruz).
 Nísia lembrou os critérios usados na escolha do projeto da vacina de Oxford, como o estágio avançado com resultados promissores e a transferência de tecnologia para uma maior oferta à população. “Oferta que só será possível graças aos investimentos que, ao longo dos anos, têm sido feitos em Bio-Manguinhos para o fortalecimento do Complexo Econômico-Industrial da Saúde no Brasil”, disse. A presidente comentou também a importância, em um contexto de emergência sanitária, de antecipar as etapas de produção, sem jamais abrir mão da segurança, eficácia e qualidade do produto, bem como do processo regulatório.
Nísia lembrou os critérios usados na escolha do projeto da vacina de Oxford, como o estágio avançado com resultados promissores e a transferência de tecnologia para uma maior oferta à população. “Oferta que só será possível graças aos investimentos que, ao longo dos anos, têm sido feitos em Bio-Manguinhos para o fortalecimento do Complexo Econômico-Industrial da Saúde no Brasil”, disse. A presidente comentou também a importância, em um contexto de emergência sanitária, de antecipar as etapas de produção, sem jamais abrir mão da segurança, eficácia e qualidade do produto, bem como do processo regulatório.
Sobre o evento adverso observado em um voluntário do estudo clínico no Reino Unido, que causou a interrupção da pesquisa durante uma semana, em setembro, Nísia afirmou que ele não prejudicará o cronograma, pois diferentes etapas do trabalho têm sido realizadas de forma simultânea. Segundo a presidente, uma paralisação como essa é normal na pesquisa clínica e demonstra que o estudo é “robusto”, pois é capaz de identificar a ocorrência, investigá-la e, comprovada a segurança da vacina, dar continuidade aos testes. “O evento infelizmente aconteceu, mas ele foi importante para demonstrar que, apesar da urgência em obter a vacina, a segurança é fundamental e está garantida. Seguindo a ética e os protocolos de pesquisa, um comitê independente avaliou o fato e deu parecer favorável à continuidade do estudo, o que aumenta ainda mais a confiança no trabalho”, explicou.
 Vigilância
Vigilância
Mais de 57 mil voluntários participam da fase 3 da pesquisa clínica em todo o mundo. No Brasil, o estudo começou com 5 mil voluntários, mas esse número já foi ampliado para 10 mil (todos com idade acima de 18 anos). “Uma interrupção como essa que ocorreu é absolutamente normal no desenvolvimento de qualquer produto farmacêutico. Quando se amplia o grupo de teste, aumenta a possibilidade de encontrar, por exemplo, um indivíduo com alguma condição pré-existente”, acrescentou o gerente-geral de Medicamentos e Produtos Biológicos da Agência Nacional de Vigilância Sanitária (Anvisa), Gustavo Santos. Para a Anvisa autorizar um estudo clínico no Brasil, ele deve ter ações de qualidade para respaldar o voluntário que se expõe àquela pesquisa, como resultados rastreáveis. Nenhum evento adverso foi observado nos voluntários brasileiros.
De acordo com o gerente-geral da Anvisa, a pandemia trouxe um novo cenário para a regulação no Brasil. “Tivemos que repensar nossos fluxos, para sermos mais rápidos sem abrir mão da segurança e da qualidade”, pontuou. Ele caracterizou o momento atual como uma “aceleração sem precedentes na história”, tanto no desenvolvimento cientifico como no processo regulatório. “Isso tem sido possível porque estamos trabalhando com vacinas já estudadas para outras doenças, o que permite aproveitar dados já existentes para acelerar fases e otimizar tempo”, lembrou Gustavo.
A aceleração do processo regulatório tem sido possível porque as instituições envolvidas no desenvolvimento e produção das vacinas estão sendo estimuladas a compartilhar dados com a Anvisa à medida que eles são gerados, de forma continuada, e não somente ao final do processo, de modo que as análises possam ser iniciadas pela Anvisa imediatamente, reduzindo o prazo de resposta a um pedido de registro. “Conseguimos, assim, antecipar uma parte das análises, mas a urgência do cenário de pandemia não nos isenta do nosso papel de regulação”, assegurou Gustavo, comentando, ainda, a possibilidade de aproveitar o trabalho já feito por outras agências reguladores e focar, de modo especial, nas especificidades da população brasileiras, como aspectos étnicos e socioeconômicos. Sobre a eficácia de vacinas, tradicionalmente, considera-se um mínimo de 70%, mas, de acordo com o gerente-geral da Anvisa, esse percentual pode vir a ser flexibilizado pelas agências reguladoras diante do cenário de ausência de alternativas terapêuticas contra a Covid-19. “A transparência das informações é fundamental, até mesmo para fazer frente aos movimentos anti-vacina”, ressaltou.
Produção
De acordo com o cronograma, com a confirmação dos resultados do estudo clínico, em novembro, a produção da vacina em Bio-Manguinhos tem início em dezembro deste ano. Primeiramente, a Fiocruz receberá o ingrediente farmacêutico ativo (IFA) da empresa Astrazeneca e Bio-Manguinhos fará a finalização e o envase. Depois, a partir de abril de 2021, a produção do IFA passa a ser feita também pela própria Fiocruz. “No ano que vem, portanto, está prevista a completa nacionalização da vacina para o nosso SUS, patrimônio da sociedade brasileira”, enfatizou Nísia sobre o projeto da vacina de Oxford. Sobre outros projetos de vacina em andamento, a presidente da Fiocruz se mostrou bastante contrária a termos como ‘corrida’ ou ‘competição’. “Precisamos de mais de uma vacina para atender à demanda global nessa situação de crise sanitária, econômica, social e humanitária. Estamos na torcida para bons resultados de outros projetos também, de modo que possamos disponibilizar vacinas com acesso equânime para a população mundial”, sublinhou.
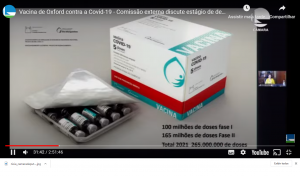
 A partir do IFA da AstraZeneca, a previsão é que Bio-Manguinhos inicie a produção de 30 milhões de doses da vacina contra Covid-19 já em dezembro deste ano, e mais 70 milhões ao longo do primeiro semestre de 2021, a um custo de três dólares por dose. “Um valor abaixo do praticado no mercado, pois produtos farmacêuticos não podem ser fonte de lucro em momento de pandemia”, lembrou Nísia. Após a nacionalização, “estima-se chegar a um total de 265 milhões de doses até o final de 2021 e, em 2022, a expectativa é produzir mais de 300 milhões”, afirmou o vice-presidente Marco Krieger. Segundo ele, os dados disponíveis até o momento indicam que a vacinação com duas doses funcionaria melhor, tendo reduzido drasticamente a ocorrência de formas graves da Covid-19 nos estudos pré-clínicos, em animais. Entretanto, mesmo com apenas uma dose, voluntários têm apresentado uma boa resposta imunológica. “É possível que o regime de vacinação definitivo seja com duas doses, mas que comecemos com apenas uma dose para que mais pessoas sejam atendidas no enfrentamento dessa emergência sanitária”, ponderou.
A partir do IFA da AstraZeneca, a previsão é que Bio-Manguinhos inicie a produção de 30 milhões de doses da vacina contra Covid-19 já em dezembro deste ano, e mais 70 milhões ao longo do primeiro semestre de 2021, a um custo de três dólares por dose. “Um valor abaixo do praticado no mercado, pois produtos farmacêuticos não podem ser fonte de lucro em momento de pandemia”, lembrou Nísia. Após a nacionalização, “estima-se chegar a um total de 265 milhões de doses até o final de 2021 e, em 2022, a expectativa é produzir mais de 300 milhões”, afirmou o vice-presidente Marco Krieger. Segundo ele, os dados disponíveis até o momento indicam que a vacinação com duas doses funcionaria melhor, tendo reduzido drasticamente a ocorrência de formas graves da Covid-19 nos estudos pré-clínicos, em animais. Entretanto, mesmo com apenas uma dose, voluntários têm apresentado uma boa resposta imunológica. “É possível que o regime de vacinação definitivo seja com duas doses, mas que comecemos com apenas uma dose para que mais pessoas sejam atendidas no enfrentamento dessa emergência sanitária”, ponderou.
 Sobre o acesso da população à vacina, o secretário de Vigilância em Saúde do Ministério da Saúde, Arnaldo Medeiros, informou que já estão em estudo, discussão e planejamento as formas de distribuição e os grupos prioritários para a aplicação da vacina, de acordo com os dados epidemiológicos disponíveis. “Estamos atentos a cada movimento para que, com a confirmação de que deu tudo certo no estudo clínico e na produção, possamos vacinar a população brasileira em 2021”, disse. O Ministério está também antecipando outras medidas necessárias, como aquisição de seringas, infraestrutura da rede de frios e postos de vacinação, bem como treinamento das equipes. “Temos tranquilidade para afirmar que, quando uma vacina contra Covid-19 chegar à população por meio do SUS, seja ela qual for, ela será segura e eficaz, como todas as vacinas hoje já disponíveis no SUS ”, concluiu o vice-presidente da Fiocruz Mario Moreira.
Sobre o acesso da população à vacina, o secretário de Vigilância em Saúde do Ministério da Saúde, Arnaldo Medeiros, informou que já estão em estudo, discussão e planejamento as formas de distribuição e os grupos prioritários para a aplicação da vacina, de acordo com os dados epidemiológicos disponíveis. “Estamos atentos a cada movimento para que, com a confirmação de que deu tudo certo no estudo clínico e na produção, possamos vacinar a população brasileira em 2021”, disse. O Ministério está também antecipando outras medidas necessárias, como aquisição de seringas, infraestrutura da rede de frios e postos de vacinação, bem como treinamento das equipes. “Temos tranquilidade para afirmar que, quando uma vacina contra Covid-19 chegar à população por meio do SUS, seja ela qual for, ela será segura e eficaz, como todas as vacinas hoje já disponíveis no SUS ”, concluiu o vice-presidente da Fiocruz Mario Moreira.
